El paciente tiene una mutación específica en un gen que le confiere resistencia frente a la demencia. iStock
Un hombre vive más de 20 años sin empeorar de su alzhéimer gracias a una mutación genética
Investigadores colombianos descubren una mutación genética que protegió a un hombre que debería haber desarrollado la enfermedad con 40 años.
15 mayo, 2023 17:01Francisco Lopera es un científico colombiano que lleva desde los años 80 estudiando una amplia familia de personas con unos mismos orígenes: una pareja vasca que se estableció cerca de Medellín hace más de 300 años. Son unas 5.000 personas de las que una parte porta una mutación genética que los sentencia a un alzhéimer temprano y devastador. Hoy se da a conocer el segundo caso de un individuo que, a pesar de todo, resistió durante más de 20 años a la enfermedad.
El equipo de Lopera acaba de publicar en Nature Medicine el caso de un individuo que debería haber desarrollado demencia con 40 años y que se mantuvo hasta los 67 con apenas síntomas de un leve deterioro cognitivo. Es el segundo caso descrito de una feroz resistencia frente al alzhéimer y, lo más sorprendente, su resiliencia tiene una procedencia distinta a la del primero.
Los investigadores de la Universidad de Antioquía, en Medellín, llevan años siguiendo a 1.200 personas de esta familia que son portadoras de una mutación del gen PSEN1 que les hace desarrollar la enfermedad de forma precoz y muy agresiva. A los 44 años ya aparece el deterioro cognitivo; a los 49, la demencia, "con raras excepciones", apuntan en el trabajo.
[Alzhéimer a los 19 años: diagnostican al paciente más joven del mundo con esta enfermedad]
Una de ellas es este caso. El hombre en cuestión solo fue a la escuela durante cinco años y estuvo trabajando hasta que se retiró pasados los 60 años. Casado y con dos hijos, cuando el equipo de Lopera le realizó la primera evaluación cognitiva solo vieron un leve desgaste. El sujeto tenía una capacidad limitada de aprendizaje verbal y cierta dificultad en el lenguaje. Por lo demás, era funcionalmente independiente, no necesitaba ayuda de nadie para realizar actividades del día a día, como vestirse o subir escaleras.
A los 70 años le diagnosticaron deterioro cognitivo leve, caracterizado por un declive de la memoria a corto plazo. A partir de ahí, su estado comenzó a empeorar rápidamente: a los 72 años había progresado a demencia leve; a los 73, requería asistencia para llevar una vida normal y síntomas de demencia moderada. Cuando murió de una neumonía, a los 74 años, sus familiares aceptaron donar su cerebro para ser estudiado.
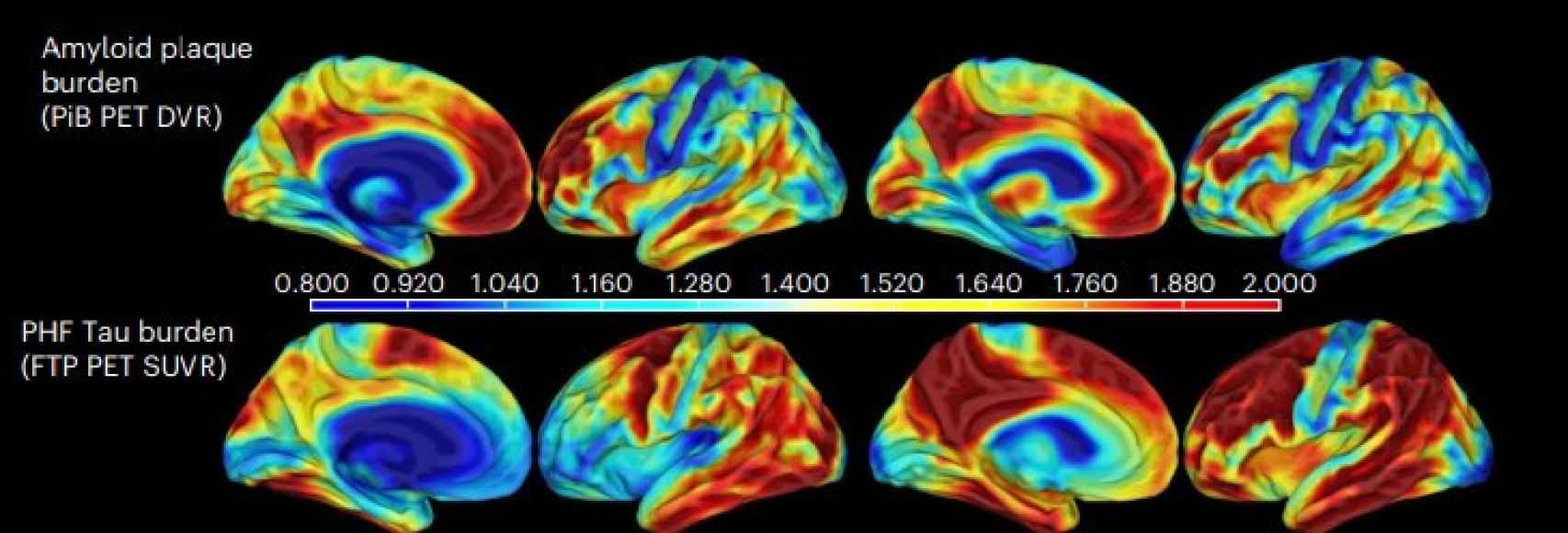
Un cerebro resiliente (izquierda) frente a uno con deterioro cognitivo. Concentraciones de amiloide (arriba) y tau (abajo). Nature
Al analizarlo, comprobaron cómo estaba considerablemente dañado por las placas de la proteína amiloide, características en el alzhéimer. Sin embargo, la proteína tau, también inherente a la patología, apenas aparecía en la corteza entorrinal, una región del cerebro que se ve afectada en las etapas tempranas de la enfermedad.
De entre todos los posibles candidatos a escudo frente a la demencia, los autores del trabajo concluyeron que una mutación en el gen RELN, que codifica la proteína reelina, era el candidato más probable. Testaron la hipótesis en un ratón que contenía esa misma variante (llamada RELN-COLBOS) y compraron como éste carecía de anormalidades estructurales en su cerebro.
El individuo estudiado había pasado más de dos décadas conteniendo la enfermedad a la que estaba sentenciado. Su hermana compartía la misma mutación en uno de los genes de la reelina (tenemos dos copias de cada gen excepto para los cromosomas sexuales), pero tenía demencia severa cuando la evaluaron por primera vez, a los 64 años.
Los autores apuntan que una grave lesión en la cabeza, que requirió cirugía reconstructiva, unida un historial de depresión e hipotiroidismo, contribuyó a un declive más temprano que el de su hermano. Con todo, pese a estar menos protegida, su deterioro cognitivo había comenzado 14 años después de lo esperado.
Factores de riesgo genético
El equipo de Lopera ya había descrito en 2019 un primer caso de resistencia al alzhéimer dentro de ese grupo de 1.200 personas con mutación PSEN1, una mujer que permació 30 años sin deterioro cognitivo.
En este caso, portaba dos copias de una mutación del gen APOE conocida como Christchurch. Otra variación de este gen, conocida como APOE4, es el principal factor de riesgo genético para todas aquellas personas que cuentan con versiones no mutadas del gen PSEN1 (solo el 1% de todos los casos de alzhéimer corresponden a la forma familiar autosómica dominante).
Eduardo Soriano, catedrático de Biología Celular de la Universidad de Barcelona e investigador principal del Ciberned, la red de investigación española en enfermedades neurodegenerativas, se muestra "muy contento" con los resultados de este estudio, ya que corrobora en humanos lo que su equipo ya había demostrado experimentalmente en ratones: "Que la expresión de reelina protege de la patología de tau, amiloide y de la pérdida de capacidad cognitiva y de aprendizaje".
[El mal hábito diario muy extendido en España que daña el cerebro y acelera el alzhéimer]
Ya en 2014 describieron esta proteína y su capacidad de resiliencia frente a la fatídica enfermedad. El trabajo actual "apunta que la neuroprotección del paciente se debe a una disminución de la patología de la proteína decitoesqueleto tau (como un elemento clave de la resiliencia), apoyando por tanto que la patología de tau es crucial en la patogénesis de la enfermedad de alzhéimer", sostiene.
De hecho, una de las posibles consecuencias de este trabajo es la desviación del interés hacia esta proteína. Hasta el momento aparecía en un segundo plano tras la beta-amiloide, principal foco de la investigación en alzhéimer durante décadas.
Sin embargo, en los últimos años ha ido creciendo el interés en tau. "La hipótesis mayoritaria es la amiloide, pero hay un consenso bastante amplio en que, por debajo, el factor crítico es tau", afirma Miguel Medina, director científico adjunto de Ciberned. "Amiloide sería el gatillo y tau sería la bala: es quien mata a la célula".
Este nuevo paradigma está todavía por demostrarse, pero el fracaso de los fármacos contra el alzhéimer dirigidos a la destrucción de las placas de beta amiloide anima a redoblar esfuerzos en su socia: ya hay fármacos contra tau en las últimas fases de ensayos clínicos.
[Terremoto en la lucha contra el alzhéimer: la principal hipótesis de la enfermedad se tambalea]
El trabajo de los investigadores colombianos, liderado por Joseph Arboleda-Velásquez y Yakeel Quiroz, de la Universidad de Harvard, y Diego Sepúlveda-Falla, de la Universidad de Hamburgo-Eppendorf, abre las puertas a una vía terapéutica potencialmente importante para combatir todo tipo de alzhéimer, no solo el familiar autosómico dominante.
"El siguiente paso es encontrar una manera de sobreexpresar o sobreactivar la vía de señalización de reelina desde el punto de vista farmacológico", apunta Medina, "y comprobar que esto tiene un efecto protector en modelos animales. Una vez comprobada esta prueba de concepto, abriría la posibilidad de desarrollo de fármacos".
Eduardo Soriano abunda en esta cuestión. "Abre un nuevo enfoque de investigación terapéutica. El principal es que, como la mutación descrita en reelina afecta a la estructura 3D de una pequeña región de la proteína, es posible técnicamente diseñar pequeñas moléculas químicas similares con potencial terapéutico".
Si este cambio es capaz de "retrasar muy significativamente la enfermedad de Alzheimer en su versión más agresiva, cabe preguntarse si los efectos serían similares (o incluso mejores) en la versión más lenta y habitual", la asociada al envejecimiento.