
Esquema de la natación autónoma del pez biohíbrido.
Crean el primer pez biohíbrido capaz de nadar gracias a células cardíacas humanas
Este biohíbrido acerca la posibilidad de construir prótesis que reemplacen por completo un corazón humano.
Noticias relacionadas
Investigadores de la Universidad de Harvard, en colaboración con equipos de la Emory University, han creado el primer pez biohíbrido y completamente autónomo a partir de células madre humanas, derivadas del músculo cardíaco. Este pez biomecánico puede nadar por su cuente al recrear las contracciones musculares del corazón al latir, lo que acerca a los científicos a desarrollar válvulas cardíacas artificiales más complejas. También ofrece una plataforma, plantean los autores, para investigar enfermedades como la arritmia.
"Nuestro objetivo final pasa por construir un corazón artificial completo para reemplazar uno con malformaciones en un niño", explica Kit Parker, autor senior del trabajo y profesor de la Escuela de Bioingeniería y Ciencias Aplicadas John A. Paulson de Harvard. "La mayor parte de los proyectos enfocados a la construcción de tejido cardíaco, incluidos los nuestros, se ha enfocado en la replicación de características anatómicas o en la recreación del latido del corazón", valora.
Lo excepcional de este trabajo, explica Parker, es que su inspiración proviene de "la biofísica del corazón", algo que es "más difícil", confiesa. "Más allá de usar una imagen del corazón como molde, estamos identificando los principios biofísicos clave que hacen funcionar el corazón, usándolos como criterio de diseño, y replicándolos en un sistema -un pez 'vivo y coleando'- que nos permite comprobar de forma mucho más sencilla si estamos teniendo éxito". El trabajo se publica en la revista Science.
El pez biohíbrido nadando con células musculares de corazón humano.
Ya en 2012, el grupo de investigación usó células del músculo cardíaco de ratas para construir una válvula biohíbrida similar a una medusa, y en 2016 desarrollaron una manta raya artificial y capaz de nadar a partir del mismo material. En este caso, se emplearon por primera vez células madre humanas derivadas de los cardiomiocitos, responsables de la contracción. Se introdujeron en un dispositivo inspirado en la forma y el movimiento del pez cebra.
Empleando este pez ampliamente utilizado en los ensayos como modelo, los investigadores dispusieron dos franjas de células musculares, cada una a un lado de la cola, para que una se contrajera mientras la otra se estiraba de forma simultánea. El estiramiento desencadena la apertura de un canal proteínico mecanosensible, lo que a su vez impulsa una contracción, y de este modo se crea un bucle de movimiento que puede propulsar al pez durante más de 100 días.
"Aprovechando las señales mecanoeléctricas cardíacas entre las dos láminas musculares, hemos sido capaces de recrear el ciclo que permite que cada contracción provoque una respuesta en forma de estiramiento del otro lado", explica Keel Yong Lee, investigador posdoctoral. "Estos resultados subrayan el papel de los mecanismos de retroalimentación para el bombeo muscular como ocurre en el caso del corazón". Para controlar el ritmo, los investigadores añadieron un nódulo autónomo que funciona de forma similar a un marcapasos.
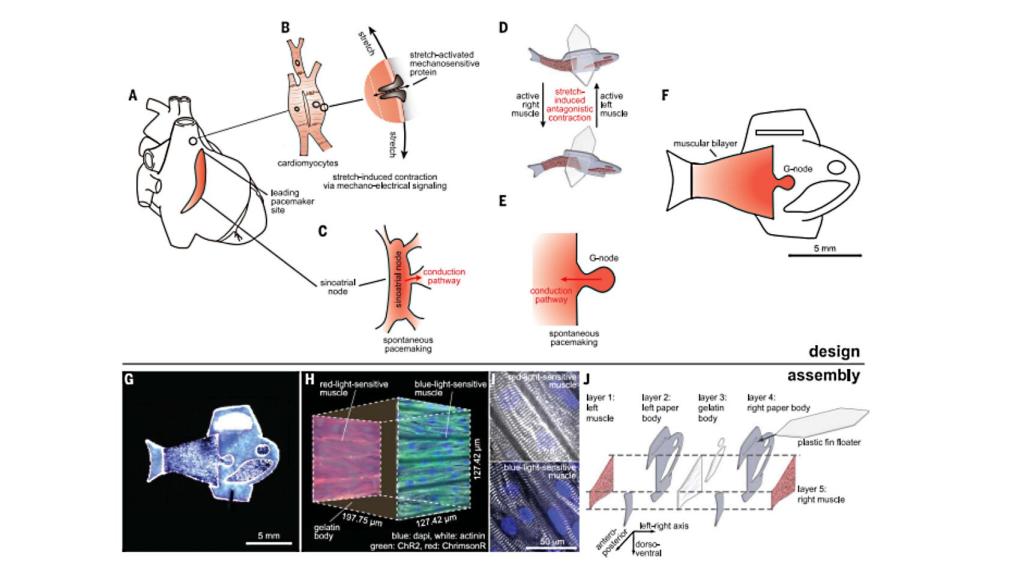
Diseño y ensamblaje del pez biohíbrido. Science.
"Mediante estos dos mecanismos internos de control, nuestro pez puede vivir más tiempo, moverse más rápido y nadar de forma más eficiente que antes", explica Sung-Jin Park, primer autor del trabajo. "Esta nueva investigación proporciona un modelo para investigar las señales mecanoeléctricas como diana terapéutica para el control del pulso cardíaco, y para entender la fisiología patológica en la arritmia cardíaca o los problemas en el nodo sinoauricular".
Además, contra lo que podría parecer, el pez biohíbrido mejora con el paso del tiempo: la amplitud de contracción muscular, la velocidad de natación máxima y la coordinación entre ambas franjas de músculo se incrementaron a lo largo del primer mes de vida, a medida que las células del cardiomiocito maduraban. Llegó un momento en el que la criatura artificial alcanzó una velocidad y eficiencia similar a la de un pez cebra vivo en la naturaleza.
"Podría fabricar un corazón humano con plastilina, pero eso no significaría que he construido un corazón", medita críticamente Parker cuando se le pregunta por las aplicaciones para el futuro. "Puedes hacer crecer células tumorales al azar en un cultivo hasta que se aglomeren en un pegote vivo y decir que has creado un 'organoide cardíaco'. Ninguno de estos trabajos, por su mismo diseño, va a ser capaz de recapitular la física de un sistema que late más de mil millones de veces a lo largo de una vida humana mientras reconstruye al momento sus propias células. Ése es el reto en el que estamos trabajando".




