La autorización de Bimervax, la vacuna contra la Covid-19 de Hipra, agita un campo que se pensaba ágil y cambiante pero que apenas ha vivido variaciones en los últimos dos años. Los cuatro primeros sueros contra la Covid fueron aprobados entre finales de diciembre de 2020 y marzo de 2021. En el otoño de 2022 comenzó una nueva ola de aprobaciones con las vacunas adaptadas a ómicron de Pfizer y Moderna, a las que se añadieron las de Novavax y Valneva (ambas usan la variante original) y Sanofi (que se basa en la beta). Ahora, el ciclo se completa con la primera inmunización desarrollada en España.
Mientras llega Bimervax, las vacunas adaptadas de Pfizer-BioNTech y Moderna son las únicas de esa nueva ola utilizadas en España. Ambas comparten tecnología, pues están basadas en ARN mensajero, frente al uso de subunidades proteicas que caracteriza a la de Hipra. En España se han inoculado (excluyendo las vacunas pediátricas) más de 90 millones de estas vacunas, de los que unos 9 millones corresponden a las adaptadas.
Hipra parte de cero. Europa suscribió un acuerdo marco para la compra de 250 millones de dosis, parte de las cuales previsiblemente adquirirá España. Junto a las vacunas adaptadas de ARN mensajero, protagonizará la próxima campaña vacunal. Estas han sido las vidas paralelas de ambas vacunas.
Funcionamiento de las vacunas
Los sueros de Pfizer y Moderna se basaban en una tecnología completamente nueva hasta el momento: el ARN mensajero. Al disponer de la secuencia genética del SARS-CoV-2, ambas compañías sintetizaron la parte que codificaba la proteína de la espícula o proteína S: se trata de la parte del virus que se une a la célula para infectarla.
Las células pueden transformar esa pequeña cadena de ARN en proteínas. De hecho, lo hacen continuamente con su propia información genética: el ADN celular se transcribe en una molécula de ARN que traspasa el núcleo y se encuentra con los ribosomas, que utilizan estas 'instrucciones' para fabricar una proteína.
Para poder transportar el ARN hasta la célula, se encapsula en un lípido. Así, la célula lo reconoce y le deja pasar. Una vez dentro, el lípido se diluye, el ARN es interceptado por los ribosomas y tras cumplir su función, se deteriora. La proteína S creada sale de la célula y se topa con el sistema inmune, que la reconoce como extraña y pone en marcha la maquinaria para neutralizarla.
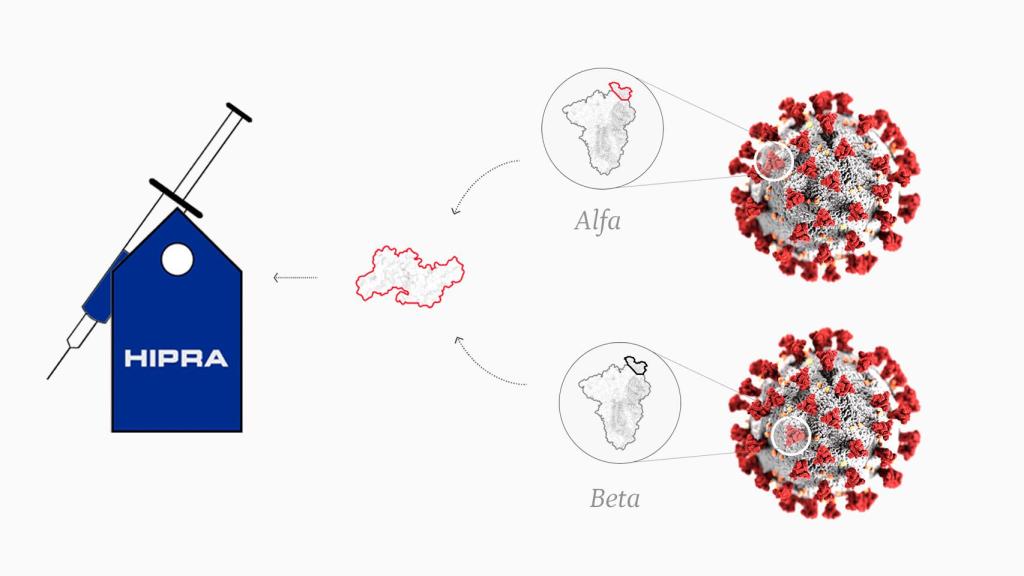
La vacuna de Hipra se salta todos esos pasos, inoculando directamente la proteína o, más bien, parte de ella: la que corresponde al sitio de unión con el receptor, la zona específica de la espícula que se une a la célula. Una vez dentro del cuerpo, el sistema inmune actúa directamente sobre ella.
Esta tecnología es habitual en las vacunas actuales, pero cuenta con un inconveniente: es más compleja para producir a gran escala ya que se crea partiendo de cultivos celulares de óvulos de hámster chino (en otras vacunas se utilizan insectos), que posteriormente se purifican para dejar solo la proteína. De ahí parte del retraso de Hipra y otras compañías que han desarrollado vacunas basadas en proteínas.
En la parte positiva, la tecnología de subunidades proteicas permite al suero desarrollado en España conservarse a una temperatura de entre 2 y 8 grados Celsius, la habitual en las neveras. En cambio, para garantizar la integridad de la molécula de ARN son necesarios súper-congeladores que la mantengan a entre -60 y -90 grados.
La proteína de Hipra difiere de las de Pfizer y Moderna en otra cuestión: es un compuesto de las variantes alfa y beta, mientras que los refuerzos de ARN mensajero se basan en una combinación del virus original de Wuhan y los linajes BA.1, por un lado, y BA.4-5, por otro, de ómicron. En realidad, hay cuatro vacunas adaptadas a ómicron: dos para BA.1 y otras dos para BA.4-5.
Aunque ya no circulen entre nosotros, las variantes alfa y beta son interesantes comparten un par de mutaciones con estos sublinajes: K417N y N501Y, presentes en todas las cepas de ómicron. Por eso Bimervax sigue estando vigente.
Una particularidad más de la vacuna de Hipra es que añade un compuesto que ayuda a la activación del sistema inmune frente a la proteína forastera. Se trata del adyuvante MF59C.1, ya utilizado en otras vacunas como las de la gripe.
Tiempo de desarrollo
Ya en enero de 2020 se consiguió secuenciar el genoma del SARS-CoV-2. A finales de mes, Moderna ya había anunciado su disposición a elaborar una vacuna basada en ese descubrimiento. Una pequeña start-up alemana, BioNTech, se propuso hacer lo mismo, pero no fue hasta marzo cuando llegó a un acuerdo con Pfizer para poder desarrollar su producto.
El camino hasta la consecución de la vacuna es ya historia de la ciencia. En menos de un año ambas estaban aprobadas tanto en Estados Unidos como en la Unión Europea: la autorización –condicional– de la EMA llegaría el 21 de diciembre de 2020 para la de Pfizer, y el 6 de enero de 2021 para la de Moderna.
El camino para el desarrollo de las actualizaciones ha tenido una duración similar. Ambas compañías afirmaban, en un principio, que tendrían disponibles las versiones dirigidas a ómicron para comienzos de la primavera de 2022, pero no llegarían hasta poco antes de cumplirse un año de la llegada de ómicron.
A comienzos de la pandemia, Hipra era una compañía dedicada a la salud animal, fabricando vacunas principalmente para ganado. En abril de 2020 decidió dar un paso adelante y poner toda su experiencia en el desarrollo de una vacuna para humanos.
La intención inicial era tenerla lista en la segunda mitad de 2021. La previsión era optimista: tardaron más de un año en hacer los desarrollos preclínicos. En agosto de ese año comenzaron los ensayos en seres humanos; la fase 3, que mide la eficacia real del producto, se inició en febrero de 2022.
En marzo se incluyó una rama nueva para personas cuya pauta inicial de tratamiento fue con vacunas de adenovirus, y en mayo comenzaron a probarla en inmunosuprimidos. Adaptándose a la situación cambiante de la pandemia, Hipra inició un ensayo de la vacuna como cuarta dosis a finales del año pasado. Tras un invierno relativamente cómodo en lo que a Covid se refiere, la Agencia Europea del Medicamento no ha tenido prisa en revisar la solicitud de Hipra, por lo que su autorización ha acabado demorándose hasta la primavera de 2023.
Inversión pública
El desarrollo de todas las vacunas ha contado con un inversor importante: el Estado. Pfizer, una de las compañías farmacéuticas más grandes del mundo, rechazó subvenciones de Estados Unidos alegando que así sus empleados no eran esclavos de la burocracia; en cambio, su socio BioNTech recibió del Gobierno alemán 375 millones de euros para el desarrollo de vacunas, a los que se sumaron 100 millones más del Banco Europeo de Inversiones, órgano de financión de proyectos de la Unión Europea.
Moderna, por su parte, logró el apoyo del National Insitute of Allergy and Infectious Diseases de Estados Unidos y la Coalition for Epidemic Preparedness, una asociación noruega que cuenta con inversiones públicas y privadas, desde los gobiernos de Noruega, Japón o Alemania hasta la Fundación Bill y Melinda Gates. Los fondos federales otorgados a Moderna para el desarrollo, ensayos clínicos y capacidad de producción de las vacunas a través de la operación Warp Speed, iniciativa del Gobierno de Donald Trump para acelerar el desarrollo de vacunas contra la Covid, ascienden a 4.100 millones de dólares.
En contraste, el Ministerio de Ciencia de España ha invertido un total de 22,34 millones de euros para el desarrollo de la vacuna de Hipra, una cantidad ciertamente menor a las anteriores. De ellos, 18 millones proceden del Centro para el Desarrollo Tecnológico Industrial (CDTI), una ayuda parcialmente recuperable.
Efectividad de las vacunas
La pauta primaria de las vacunas de Pfizer y Moderna lograba una eficacia superior al 90% evitando infecciones. Esta fue decayendo con la llegada de nuevas variantes, si bien mantenían su potencial frente a enfermedad grave. La caída de anticuerpos con el paso de los meses y la llegada de ómicron hizo esencial la vacunación de refuerzo.
La aprobación por parte de la EMA de la vacuna de Pfizer se basa en un estudio en personas mayores de 55 años. La respuesta inmune frente a la subvariante BA.1 fue un 14,6% mayor tras un segundo refuerzo con la vacuna adaptada que con la cuarta dosis de la original. Los datos de la vacuna adaptada a BA.4-5 se infieren a partir de estos.
Los estudios presentados para la aprobación de la vacuna de Moderna observan la misma conclusión. Además, la EMA subraya que sus resultados pueden aplicarse igualmente a la vacuna adaptada como primera dosis de refuerzo, así como para los adolescentes de entre 12 y 17 años, dado que los datos previos con dicho suero mostraron un efecto comparable.
Sin embargo, un nuevo análisis aparecido el pasado otoño señalaba que el nivel de protección frente a enfermedad grave de estas nuevas vacunas sería similar al que ofrece un booster con la original. No obstante, este estudio se basa en una predicción de los beneficios de las vacunas basándose en los niveles de anticuerpos, no es una medición de resultados clínicos reales.
Todavía no están disponibles para la comunidad médica los datos de Hipra de los ensayos clínicos, si bien la compañía ha desvelado algunos números que pueden dar una idea de la efectividad de esta vacuna como refuerzo frente a la tercera dosis de las vacunas de ARN.
Elia Torroella, directora de I+D y registros de la farmacéutica, compartía en una entrevista con EL ESPAÑOL estos datos preliminares. Mientras que el refuerzo con Pfizer multiplicaba por 67 los anticuerpos neutralizantes inmediatamente anteriores, en el caso de Hipra crecían 147 veces. El verano pasado, la propia Torroella señaló que la vacuna ha mostrado, además, una buena respuesta neutralizante frente a los sublinajes BA.4 y BA.5.