
Marcos Blanco, becario predoctoral; Antonio Tabernero, profesor contratado doctor; Eva Martín del Valle, catedrática; e Inmaculada de Dios, becaria predoctoral, en el laboratorio de Ingeniería Química de la Facultad de Ciencias de la USAL IBSAL
Una investigadora del IBSAL diseña un hidrogel inyectable para un tratamiento menos tóxico del cáncer de mama
Eva Martín del Valle, investigadora del IBSAL y catedrática de Ingeniería Química de la USAL, ha validado un gel termosensible -que utiliza PF-127 (Poloxamer 407) combinado con goma gellan- con un sistema nanotecnológico de liberación de fármacos contra el cáncer de mama HER 2+
30 noviembre, 2023 13:57Noticias relacionadas
- La Universidad de Salamanca lidera el impulso en la medicina de precisión en pacientes con cáncer biliar
- Un nuevo fármaco frente a un transportador de aminoácidos es efectivo en cáncer de colon
- Los institutos de investigación de Castilla y León, los laboratorios a disposición del talento para mejorar la vida de los ciudadanos
La profesora Eva Martín del Valle, investigadora del Instituto de Investigación Biomédica de Salamanca (IBSAL) y catedrática de Ingeniería Química de la Universidad de Salamanca (USAL), ha liderado el desarrollo de un sistema innovador de liberación de fármacos para la terapia local del cáncer de mama que consiste en un gel termosensible e inyectable, a base del polímero Poloxamer 407 y goma gellan, y que incluye nanopartículas inteligentes para atacar el tumor de forma localizada.
El trabajo, publicado en Journal of Pharmaceutical Sciences, y en el que también han colaborado investigadores de los Departamentos de Ingeniería Química e Informática y Automática de la USAL y del Instituto de Medicina Traslacional de Birmingham, se completará ahora con el desarrollo de modelos computacionales que simulen la aplicación de este gel para rellenar la zona reseccionada en las intervenciones de cáncer de mama. Un estudio que se está llevando a cabo en colaboración con el Profesor Sasa Kenjeres, de la prestigiosa Universidad de Delft, y que también será publicado próximamente.
Como explica Eva Martín del Valle, “los sistemas locales de administración de fármacos son fundamentales en el tratamiento del cáncer, ya que ofrecen una serie de ventajas que mejoran la eficacia terapéutica y reducen los efectos secundarios asociados con los tratamientos convencionales”. Estos enfoques están en constante desarrollo y son una parte activa de la investigación en el campo de la Oncología.
En este contexto, la responsable del grupo Nanotecnología para el Tratamiento del Cáncer del IBSAL trabaja desde hace años en biomateriales que ofrecen oportunidades para diseñar sistemas de administración más eficientes y específicos que pueden revolucionar la forma en que se aborda el tratamiento del cáncer, gracias a estrategias terapéuticas más personalizadas en la lucha contra esta enfermedad.
En el presente trabajo, el objetivo final de la aplicación del hidrogel es obtener un tratamiento local para cánceres de mama HER 2+, que son de los que peor pronóstico presentan, según explica la investigadora.
De este modo, el equipo ha desarrollado un material que es líquido a temperatura ambiente y se transforma en sólido a temperatura fisiológica (37 grados), gracias a la combinación de los dos componentes utilizados, el polímero PF-127 y la goma gellan, ambos aceptados por la FDA como biocompatibles con el ser humano y utilizados normalmente en alimentación. Este hidrogel contiene, además, un sistema de liberación nanotecnológico que permite soltar en una zona específica dos componentes farmacológicos: “Uno que frena la formación de nuevas células tumorales y otro que mata células tumorales. Combinamos así la reprogramación celular y la quimioterapia”, añade la catedrática.
Inyectar en el tumor o rellenar la zona reseccionada
La idea pasa por inyectar directamente en el tumor o, cuando se está haciendo la resección en cáncer de mama —aunque también sería aplicable en cáncer de colon—, rellenar la zona con el gel en líquido, que luego se solidificaría y acabaría destruyendo células cancerígenas residuales, inapreciables en anatomía patológica, pero que son las que finalmente pueden provocar la recidiva de la enfermedad.
“El gel no solo responde a la temperatura fisiológica, sino que está diseñado con nanopartículas inteligentes que activan la liberación de los fármacos aprovechando los cambios en el pH del tumor, logrando así afectar solamente a las células tumorales, mejorando la especificidad y disminuyendo los efectos secundarios”, matiza Eva Martín del Valle.
De momento, el sistema ya ha sido probado in vitro y ahora se probará in vivo en modelos de ratón, dejando abierta la puerta a un posible ensayo clínico en el futuro, que sería pionero a nivel mundial y totalmente factible, ya que, por un lado, los materiales utilizados son biocompatibles y, por otro, los tratamientos farmacológicos que se liberarían ya han sido probados con eficacia en la clínica.
Etapas en el desarrollo del proyecto
El diseño de este hidrogel inyectable para el tratamiento localizado y menos tóxico del cáncer de mama ha pasado por diferentes etapas programadas. En primer lugar, la optimización y caracterización de los materiales; posteriormente, la incorporación de forma adecuada de los nanosistemas en el gel y, finalmente, la validación del sistema con células tumorales.
“En esta primera etapa hemos colaborado con la profesora Patricia Pérez Esteban de la Universidad de Aston en UK, y también con profesores de Automática y Control de la Universidad de Salamanca, que han diseñado un dispositivo en impresora 3D para simular el flujo en un órgano”, comenta la líder del proyecto.
En la actualidad, y gracias a la estancia de Álvaro González, del grupo de investigación de Eva Martín del Valle, en la Universidad de Delf, en los Países Bajos, se trabaja en una simulación para comprobar que la cantidad de gel y de fármaco liberado en función de dónde está ubicado el tumor en la mama coincide con lo que realmente predice el modelo.
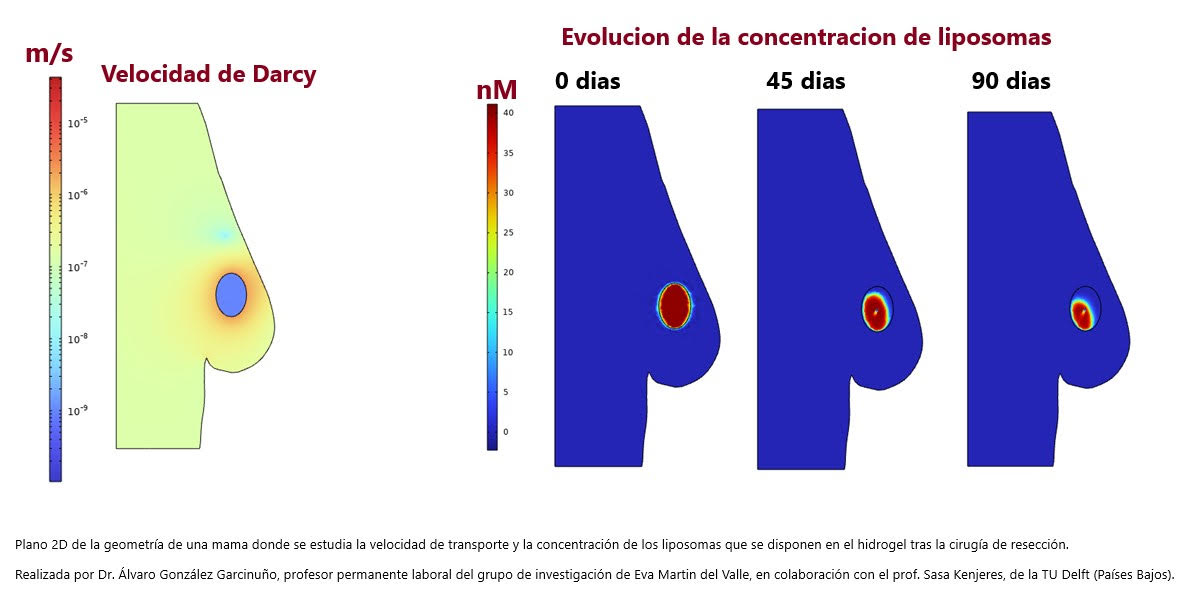
Para ello, y tomando como base un compendio de imágenes de mamografía y ecografía facilitadas por el hospital de Rotterdam, “lo que hacemos es extraer geométricamente el tumor y, en un modelo ficticio en tres dimensiones, comprobar la cantidad de material que habría que suministrar en función de la situación de cada paciente, estudiando, como se aprecia en el gráfico adjunto, la velocidad del transporte y la concentración de liposomas, que responden a los cambios del pH en la zona del tumor para liberar el fármaco”.
De esta forma, “conociendo las dimensiones y la situación del tumor, y aplicando este modelado matemático, podemos predecir la cantidad de gel a inyectar y las dosis necesarias de fármacos. Además, la inclusión de nanopartículas que responden a estos cambios de pH hará que se controle la liberación en las zonas afectadas por células tumorales, aumentando la selectividad”, concluye la investigadora.





