
Una trabajadora preparando los viales de la vacuna contra la Covid de Pfizer, en las instalaciones de Puurs (Bélgica). Pfizer.
Una alianza, tecnología innovadora y cuatro posibles vacunas: así desarrolló Pfizer su antígeno contra la Covid
Cristina Méndez, directora médica de vacunas de Pfizer en el sur de Europa, cuenta cómo ha sido el proceso hasta la aprobación de Comirnaty.
Noticias relacionadas
Nueve meses. Es lo que Pfizer ha tardado en desarrollar y poner en el mercado su vacuna contra la Covid-19. Un tiempo en el que la compañía estadounidense y la alemana BioNTech han trabajado codo con codo en la búsqueda de una potencial solución a la pandemia. Cuatro fueron los candidatos iniciales con los que las farmacéuticas comenzaron a investigar. De estos, finalmente, quedó uno: la vacuna contra el coronavirus que ya se está administrando en todo el mundo y que se conoce como Comirnaty.
La alianza de Pfizer con BioNTech ya venía de atrás. Fue en 2018 cuando firmaron un acuerdo de colaboración con el objetivo de desarrollar un antígeno contra la gripe y que ahora ha servido también para hacer frente a la pandemia.
Tal y como ha contado Cristina Méndez, directora médica de vacunas de Pfizer en el sur de Europa, durante su intervención en la XIV Conferencia Anual de las Plataformas Tecnológicas de Investigación Biomédica, "BioNTech tenía los derechos de propiedad intelectual de la tecnología innovadora basada en ARN mensajero y Pfizer las competencias en materia regulatoria y la capacidad de producción".

La vacuna de Pfizer fue la primera en ser aprobada en el mundo.
Ambos laboratorios tenían los ingredientes principales para desarrollar la vacuna. Y se pusieron manos a la obra con la selección, en un primer momento, de hasta cuatro candidatos a convertirse en antígeno contra la Covid-19.
De estos, dos fueron los que mejores resultados obtuvieron en las primeras fases de los ensayos clínicos. Finalmente, solo quedó uno: la vacuna contra la Covid-19 que fue aprobada para su uso en la Unión Europea el pasado 21 de diciembre de 2020.
La plataforma de ARN mensajero
¿Qué se sabía de la plataforma de ARN mensajero en la que se ha basado la vacuna de la Covid desarrollada por Pfizer y BioNTech? "Partía del concepto de que lo que se administra al sujeto es el código genético que, una vez en el interior de la célula, aprovecha la maquinaria de esta para la fabricación del antígeno, que es la que produce la respuesta inmune", ha explicado Méndez.
Para fabricar la vacuna contra el coronavirus, "partimos de la amplificación del material genético del SARS-CoV-2 e identificamos la parte de este material que expresaba la proteína S (que es la proteína que se une al receptor celular y media en la actividad de fusión de membranas). A partir de ahí, creamos una secuencia de ARN mensajero que se encapsula como vehículo para su transporte, administración y liberación en el interior de la célula".

Una de las salas de formulación de la planta de Pfizer en Puurs (Bélgica).
Además de la seguridad y de la buena respuesta inmune que se había comprobado que tenía en estudios en animales, el uso de esta tecnología "nos permitía un desarrollo y escalado de dosis rápido, algo fundamental en plena pandemia", ha continuado Méndez.
Esta fue la base para proponer esta tecnología como base para la vacuna contra la Covid de Pfizer y BioNTech y el 11 de marzo comenzaron a probar sus prototipos en modelos animales.
El proceso
Fue el 23 de abril cuando las compañías iniciaron el ensayo clínico fase 1/2 en Alemania y el 4 de mayo en Estados Unidos. Como se ha mencionado anteriormente, fueron cuatro los candidatos que comenzaron a probarse, aunque finalmente quedó uno. Fue el 24 mayo cuando decidieron cuál sería el candidato final con el que iniciarían la fase 3 del estudio.
Comenzó entonces el periodo de reclutamiento de pacientes. El antígeno de Pfizer se probó en más de 43.000 personas y según iban disponiendo de datos se los iban comunicando a las agencias reguladoras del mundo, entre ellas, la Agencia Europea del Medicamento (EMA, por sus siglas en inglés).
El ensayo clínico se inició con los cuatro candidatos, probando además diferentes rangos de dosis y en distintos grupos de edad. Dos de estos pasaron este primer filtro, pero finalmente decidieron que fuera el candidato B2 el que siguiera adelante con una dosis de 30 mg.
Fue con este con el que las compañías iniciaron la fase 3 -la última- del ensayo clínico en el mes de julio y que se llevó a cabo en diferentes países donde la tasa de contagios era más alta (entre ellos, Estados Unidos, Sudáfrica, Turquía o Alemania).
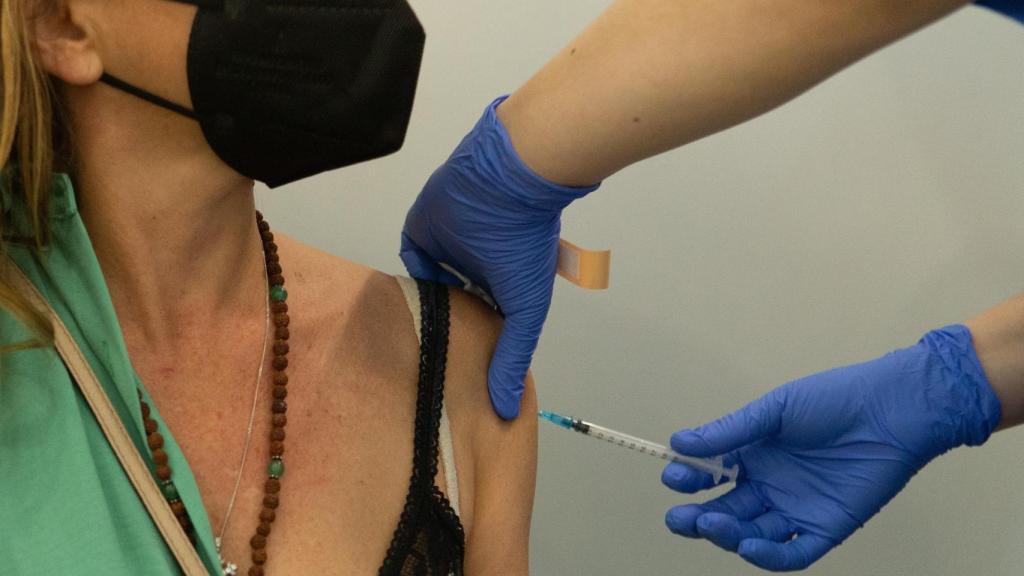
Una enfermera vacuna a una mujer en el centro de vacunación de la Fira de Barcelona.
En la fase final del estudio, los laboratorios comprobaron que con la administración de una segunda dosis, separada por 21 días de la primera, se lograba una buena respuesta inmune suficiente para obtener una protección óptima frente a la enfermedad.
Para lograr el desarrollo de la vacuna en apenas 9 meses, las compañías fueron solapando las distintas fases del ensayo clínico. Además, incluso antes de iniciar la última parte del estudio, las compañías comenzaron a producir a riesgo las primeras dosis del que todavía era candidato a vacuna contra la Covid.
Gracias al temprano inicio de la producción de dosis, las compañías estaban preparadas para enviar las primeras vacunas en cuanto recibieron la aprobación por parte de la EMA. En España, la primera dosis se puso el 27 de diciembre de 2020. Empezaba entonces el principio del fin de esta pandemia.




