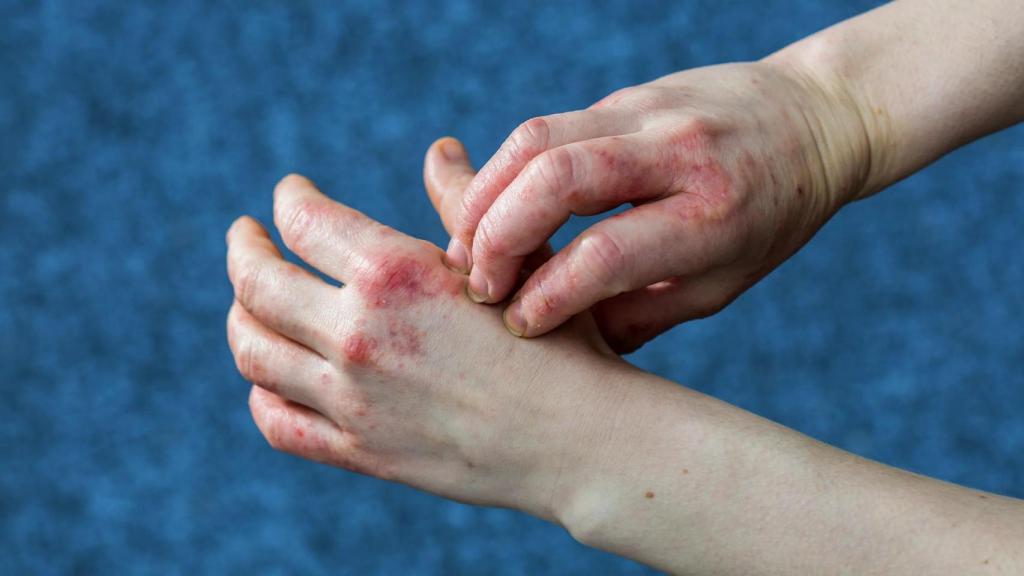
Eccema de manos grave.
España lanza Anzupgo, el primer tratamiento tópico para adultos con eccema crónico de manos grave
LEO Pharma ha sido el laboratorio farmacéutico encargado de ello.
Más información: Leo Pharma elevó un 4% su facturación en 2024 en España, hasta los 96,9 millones de euros
LEO Pharma, laboratorio farmacéutico especializado en dermatología médica, ha anunciado el lanzamiento en España de Anzupgo (cuyo principio activo es delgocitinib).
Se trata del primer tratamiento tópico indicado para adultos con eccema crónico de manos grave (ECM) para quienes los corticosteroides tópicos son inadecuados o inapropiados.
“Este lanzamiento refuerza nuestro compromiso con los pacientes y con la innovación terapéutica en dermatología médica”, ha señalado Juan Fran Cuello de Oro, Director General de LEO Pharma España.
Por su parte, Marcin Kozarzewski, director médico de LEO Pharma España ha explicado que "esta enfermedad se trata de una patología inflamatoria altamente incapacitante, con un impacto físico, emocional y laboral considerable. La disponibilidad de una nueva opción terapéutica representa un avance relevante para los profesionales sanitarios y los pacientes”.
Su aprobación se basa en los resultados de los ensayos clínicos de fase 3 DELTA 1 y DELTA 2 que evaluaron la seguridad y eficacia del tratamiento en comparación con el vehículo en crema, ha detallado el laboratorio en un comunicado.
Perfil terapéutico
Su perfil terapéutico también fue evaluado dentro del ensayo clínico fase 3 Delta Force, primero en comparar directamente un tratamiento tópico con uno sistémico para el eccema crónico de manos grave.
El ensayo analizó su eficacia frente a alitretinoína en cápsulas, hasta ahora única opción aprobada en España para pacientes con ECM grave que no respondían a corticoides tópicos.
Delgocitinib alcanzó el objetivo primario al lograr una mayor reducción en la puntuación del índice de gravedad del eccema (HECSI) a las 12 semanas.
Además, mostró mejores resultados en los objetivos secundarios: éxito terapéutico según la Evaluación Global del Investigador (IGA-CHE), reducción sostenida de HECSI hasta la semana 24 y mejora en la calidad de vida relacionada con la salud (DLQI).
El estudio también indicó que presenta un perfil de seguridad más favorable, con menor incidencia de reacciones adversas y sin eventos adversos relacionados con el tratamiento.