Un grupo de trabajo liderado por el científico titular del Centro de Investigación del Cáncer de Salamanca (CIC-IBMCC) Miguel Vicente-Manzanares ha publicado nuevos avances sobre las texturas celulares y su posible implicación en procesos tumorales.
Este "importante descubrimiento" ha recibido apoyo financiero del Ministerio de Economía y Competitividad, la Junta de Castilla y León, la Asociación Española contra el Cáncer y las fundaciones Ramón Areces y BBVA.
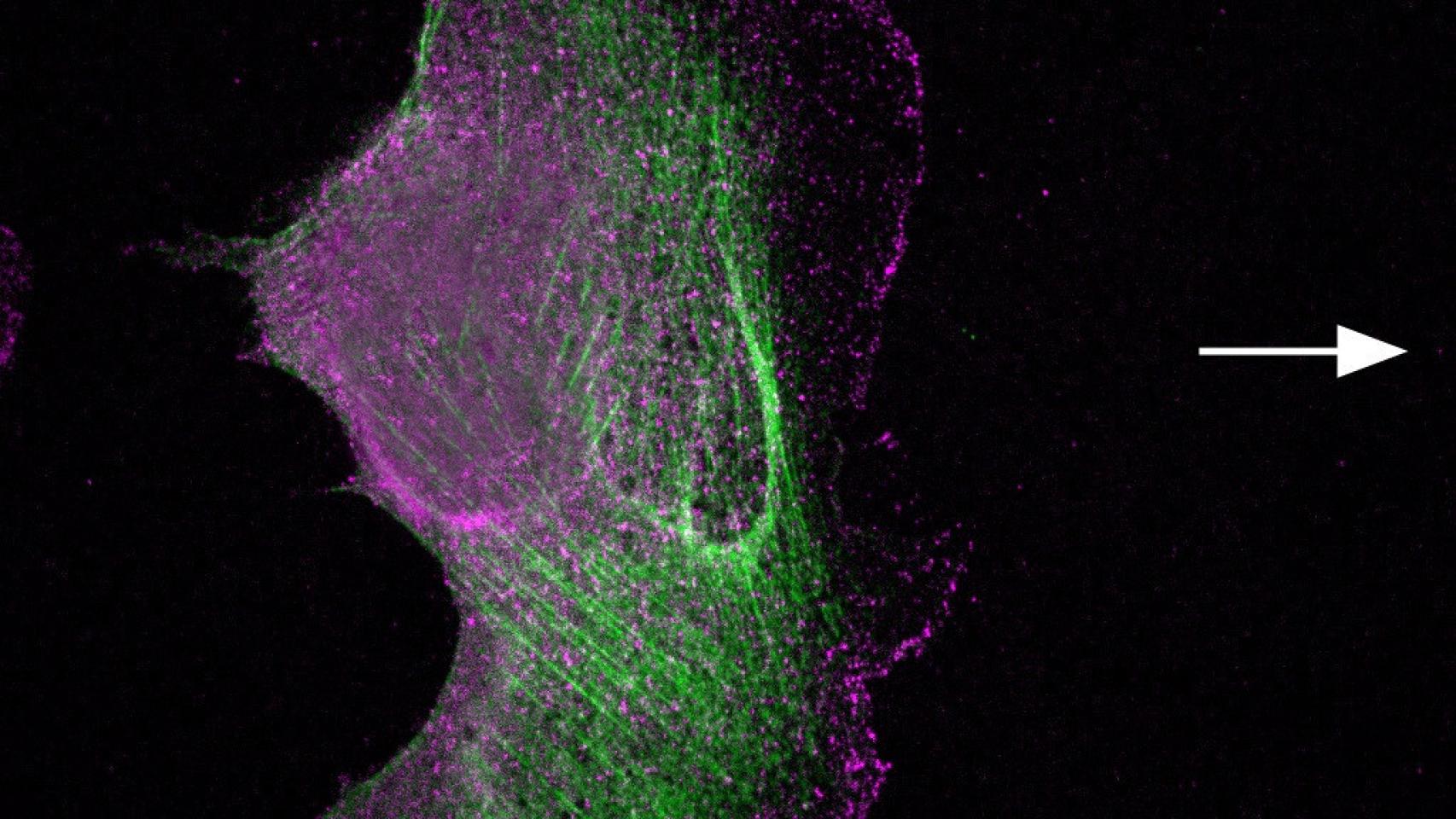
Según la información facilitada por el centro investigador salmantino, la textura de un tejido depende de varias propiedades, como el grado de densidad de las células, el tipo de proteínas que rodean a las mismas y la capacidad de las células para organizar el conjunto y endurecerlo, o mantenerlo blando.
Para ello, las células disponen de "nano-motores" que generan la fuerza necesaria para mantener o cambiar su forma y la de su entorno; así, desde esta perspectiva, la formación de los tejidos es un proceso biofísico, aspecto que se suma a las tradicionales aproximaciones bioquímicas y genéticas, que han dominado la biología hasta ahora, ha explicado el CIC.
El nuevo campo de la mecánica celular (o mecanobiología) integra "todos estos aspectos para desentrañar cómo funciona la maquinaria que controla estos procesos cuando ocurren normalmente, y trata de identificar elementos de desviación de la normalidad que causan cáncer y otras enfermedades".
Ante esta perspectiva, el CIC ha indicado que " el principal nano-motor celular que genera fuerza dentro de las células se denomina miosina II" y que existen distintas variantes (musculares y no musculares) que tienen funciones esenciales en procesos básicos para la vida, desde el movimiento voluntario de los músculos hasta los movimientos involuntarios, como la respiración y el latido del corazón.
INVESTIGACIÓN PREVIA
El trabajo previo del grupo del Doctor Miguel Vicente-Manzanares había demostrado la existencia y había estudiado la función de proteínas similares a las miosinas II musculares en todos los tejidos, incluso en neuronas y células sanguíneas.
Esencialmente, todas las miosinas II, tanto las musculares como las no musculares, están compuestas por dos cadenas pesadas y cuatro ligeras, y la variante no muscular se encuentra en todas las células del organismo, que es el objeto de este estudio.
Tal y como ha explicado, esta proteína "controla todos los aspectos de la vida de la célula", al generar la fuerza necesaria para que la célula tenga una forma concreta u otra y determina su capacidad para moverse o dividirse, entre otras aspectos.
NUEVOS AVANCES
Ahora, en el último número de la revista científica Current Biology, el grupo describe un avance "esencial" para comprender los mecanismos que permiten a las células controlar su textura, y que es esencial para su capacidad de movimiento y especialización.
El trabajo del grupo del especialista Vicente-Manzanares concluye que una modificación concreta de una de las cadenas ligeras de la miosina II no muscular bloquea su función "a demanda".
Según el CIC, este mecanismo había permanecido inédito hasta este estudio, pero es "un avance esencial para comprender cómo las células se adaptan a su entorno y reciben señales del mismo para migrar, dividirse o cambiar su textura para formar un tejido".
Para concluir, el centro salmantino ha reseñado que este trabajo es "pionero" porque demuestra que la modificación descrita impide que la miosina II forme los entramados que forman el "esqueleto celular" o citoesqueleto, que es necesario para que la célula tenga una forma concreta, se relacione con las células de su entorno inmediato y pueda moverse o dividirse.
En concreto, la modificación descrita es una fosforilación en tirosina (Tyr155), que es una forma común de modificación de las proteínas para cambiar su función, y la fosforilación en tirosina 155 de la cadena ligera de la miosina II no muscular, objeto del estudio, impide que la miosina II forme entramados filamentosos que "son necesarios para generar fuerza.
"ALBAÑIL"
En este sentido, la miosina II ensamblada (no fosforilada en tirosina 155) actuaría como "un albañil, que usa su fuerza para colocar y cementar los componentes de la célula, y así permitir su actividad normal", ha puesto como ejemplo para su explicación.
Según el artículo, la fosforilación en tirosina actúa como una "pausa forzosa para comer", al detener el ensamblaje de la miosina, lo que impide "el acceso del albañil a la obra", ha continuado con su explicación.
El CIC ha subrayado que "es importante reseñar" que la fosforilación de otros componentes de la miosina II es "esencial para su función y ensamblaje", lo que significa que esta fosforilación es parte de un complejo sistema de señales positivas y negativas que activan o inactivan la miosina II en función de las condiciones precisas de la célula y su entorno.
Por ello, "este descubrimiento es básico para entender cómo las células controlan la cantidad exacta de fuerza que necesitan para realizar cada proceso y abre la puerta al estudio de la alteración de esta modificación en diversos tipos de cáncer caracterizados por la displasia, o pérdida de la forma celular, y la invasión y metástasis, que son procesos en los que la mecánica celular está alterada, haciendo que las células cancerosas, que no deberían migrar, se trasladen a otras regiones para formar tumores secundarios", ha concluido.